
CARACTERIZAÇÃO FÍSICO- QUÍMICA E ATIVIDADE ANTIOXIDANTE DA POLPA DE JENIPAPO (Genipa Americana L.) PARA OBTENÇÃO DE NOVOS ALIMENTOS FUNCIONAIS E NUTRACÊUTICOS
Amélia Carolina Glória Panhu da Silva; Jefferson Adan Cavalcante Lopes; Maira Sophia Ribeiro De Araujo; Fabiano Moreira Dutra; Kianna Vitoria Dos Santos Ferreira; Lindalva Maria de Meneses Costa Ferreira; Rayanne Rocha Pereira
*Autor correspondente (Corresponding author) – Email: rayanne.pereira@ufopa.edu.br
DOI: 10.53934/agronfy-2025-01-11
ISBN: 978-65-85062-21-3
Este capítulo faz parte da coletânea de trabalhos apresentados no III Congresso Brasileiro de Ciências dos Alimentos publicado no livro: Avanços e Pesquisas em Ciência dos Alimentos – Acesse ele aqui.
Vídeo de apresentação do capítulo
RESUMO
O jenipapo é um fruto nativo da Amazônia, onde é usado na alimentação e tem alto valor cultural. Este trabalho teve o objetivo de caracterizar a polpa de jenipapo quanto aos seus parâmetros físicos, físico-químico, composição química e atividade antioxidante. Foram estudados frutos em dois estágios de maturação (verde e maduro). Os frutos maduros pesavam 166,32g, sendo 50,10g das sementes, 35,91g de casca e 75,26g de polpa. Enquanto o fruto verde apresentou peso médio de 189,63g, sendo 58,75g de sementes, 44,14 de casca e 82,84 de polpa. O teor de umidade foi de 83,33% na polpa do fruto maduro e 79,73% na polpa do fruto verde, enquanto que o teor de cinzas (g/100g) foi de 0,05g e 0,03g para os frutos maduro e verdes, respectivamente. Os frutos verdes apresentaram maior conteúdo de flavonoides (150,97 mg Eq Rut. g/ polpa) e polifenóis (300,69 mg Eq AG. g/polpa) do que os frutos maduros (flavonoides- 110,63 mg Eq Rut. g/ polpa e polifenóis- 180,30 mg Eq AG. g/polpa). Ao mesmo tempo que a atividade antioxidante foi maior nos frutos maduros, para as três metodologias testadas, FRAP, DPPH e ABTS. Os resultados desse trabalho permitiram verificar o potencial que o jenipapo, nos dois estágios de maturação analisados, tem para produção de alimentos funcionais e nutracêuticos.
Palavras-chave: Jenipapo, flavonoides, DPPH, ABTS, FRAP
INTRODUÇÃO
O Jenipapo (Genipa americana L.) é nativo do Norte da América do Sul, mas é encontrado desde o México até o Norte da Argentina. No Brasil, está distribuído em todos os biomas, com exceção dos pampas, é presente na Amazônia, Cerrado, Mata Atlântica, Caatinga e Pantanal. A árvore do jenipapo é conhecida como jenipapeiro, uma Rubiaceae de ocorrência em áreas de vegetação secundária de várzeas situadas em locais inundados(1).O jenipapo é uma fruta tradicional em várias comunidades indígenas onde é utilizado em pinturas corporais. É uma fruta importante não somente por seus benefícios biológicos ou nutricionais, mas também por sua carga cultural (2). Em muitas áreas é considerado uma fruta exótica, sendo conhecido e consumido, predominantemente, onde é originário.
O jenipapo é consumido in natura, como licor ou na forma de suco e geleias. A polpa de jenipapo contém, em média 1,60% de lipídios, 0,67% de proteínas, 20% de carboidratos, 2,20% de sais minerais e cerca de 9% de fibras(3,4). Além de seu valor nutricional, é utilizado na medicina popular como catártico, antidiarreico, antigonorréico, antiulceroso, analgésico e em casos de anemia, icterícia, asma, hidropsia, problemas de fígado e baço (5).
Ademais, na literatura cientifica há vários estudos sobre as propriedades biológicas desse fruto. Estudos in vitro mostraram sua atividade antiglicante (6), anticancerígeno, hipoglicemiante(7) e antioxidante(3). A ampliação dos estudos sobre o jenipapo é importante para expandir suas possibilidades de uso e ajudar na catalogação de suas características físico-químicas, uma vez que o jenipapeiro é encontrado em várias localidades, de clima e vegetação diferentes é importante a caracterização das propriedades biológicas e físico-química do jenipapo de diferentes procedências.
A Caracterização Físico-químico (pH, sólidos solúveis, umidade e cinzas), bem como de compostos com interesse funcional e atividade antirradical livre para polpas das espécies frutíferas amazônicas, é importante para a valorização desses frutos. Os radicais livres são espécies instáveis que são formadas a partir de processos metabólicos celulares. Esses radicais livres podem ser prejudiciais à célula quando seus níveis excedem os do sistema antioxidante celular, em um processo conhecido como estresse oxidativo. Frutas e vegetais são conhecidos por apresentarem altos níveis de antioxidantes, entre eles estão os carotenoides, flavonoides, polifenóis e vitaminas, a presença dessas substâncias nas frutas é responsável pelas vantagens biológicas relacionadas ao seu consumo, tais como neuroproteção, atividade antiinflamatória, anticancerígena, entre outras(8–10).
A quantificação de polifenóis e flavonoides na polpa do jenipapo, tal como a determinação da atividade antioxidante é interessante não somente por seus benefícios biológicos, mas também pela vantagem tecnológicas que esses compostos cedem aos alimentos que constituem. Antioxidantes naturais protegem os alimentos contra oxidações, aumentando seu tempo de prateleira, e contribuem para a diminuição do uso de substâncias sintéticas de mesmo propósito(11,12). O objetivo deste trabalho foi analisar as características físicas e físico- química dos frutos de jenipapo verde e maduro, assim como determinar o conteúdo de polifenóis, flavonoides e a capacidade antioxidantes do jenipapo, afim de avaliar o potencial desse fruto ser usado como insumo alimentar no desenvolvimento de alimentos funcionais e nutracêuticos.
MATERIAIS E MÉTODOS
Materiais
Carbonato de sódio e cloreto de alumínio, persulfato de potássio, cloreto férrico hexahidratado, sulfato ferroso heptahidratado, 2,4,6-tris(2-piridil)-s-triazina (TPTZ) foram adquiridos na LabSynth (São Paulo, Brasil). O ácido gálico, rutina, 2,2-diphenyl- 1-picrylhydrazyl (DPPH), 2,2-azinobis (3-ethylbenzothiazoline-6) sulfonic acid)(ABTS) ≥ 98%, ácido (±) -6-hidroxi-2,5,7,8-tetrametil-cromano-2-carboxílico (Trolox), foram adquiridos na Sigma-Aldrich (St. Louis, Missouri, United States).
Amostra
Os frutos de jenipapo foram coletados em dois estágios de maturação (maduros e verdes), no município de Jacareacanga – PA, Brasil (05º 05’ de latitude sul,42º 48’de longitude oeste), em agosto de 2023. Após a coleta os frutos foram devidamente higienizados, pesados e em seguida descascados, despolpados, e por fim as sementes foram retiradas. As sementes, polpa e casca, foram, separamente, pesados e armazenados em temperatura de 8°C até o momento da utilização.
Caracterização físico-química da polpa do Jenipapo
A polpa íntegra dos frutos verdes e maduros do jenipapo foi submetida a análise de cinzas e umidade. Foram pesados 10g da polpa de jenipapo em uma cápsula de porcelana. A amostra foi submetida a um calor de 105°C, em uma estufa (NI 1510 – Estufa de Esterilização e Secagem 15L) durante 4 horas para determinação da umidade, e, à 550ºC na mufla durante 2 horas para determinação de cinzas. Foram feitas pesagens sucessivas, até que a massa estivesse constante(13). A análise foi feita em triplicata. O cálculo da umidade e de cinzas seguiu a Equação 1.
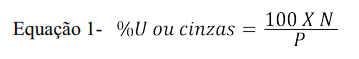
Onde %U é a porcentagem de umidade, N é a massa perdida (em g) e P a massa inicial da amostra.
Preparo da amostra
Para a realização das demais análises de caracterização e da atividade antioxidante foi necessário preparar um suco da polpa de jenipapo para posterior liofilização. Foi produzida um suco, com grau Brix 16 para o fruto maduro e grau brix 15,2 para o fruto verde. Esse suco foi preparado usando a massa total da polpa de jenipapo com 200mL de água.O suco do jenipapo de ambos os frutos verdes e maduros foram então congelados para posterior liofilização, usando o liofilizador (LIOTOP – modelo 101) por um período de 72 h.Antes do congelamento foi mensurado o pH, usando um pHmetro digital de bancada (QUIMIS Q400MT, São Paulo, Brasil).
Termogravimetria (TG)
A polpa liofilizada, dos frutos de jenipapo (verde e maduro) foram submetidas a análises de termogravimetria (TG). Em um cadinho de platina foram pesadas 5 mg de cada amostra e submetidas a um regime de aquecimento de 10°C/min até temperatura de 600°C, em atmosfera de nitrogênio (N2), fluxo de 50mL/min. A análises foram performadas em um analisador térmico Shimadzu® TGA- 50 (Shimadzu, Kyoto, Japan), os resultados foram analisados no software TGA- 50 (Shimadzu, Kyoto, Japan).
Determinação de Polifenóis Totais e Flavonoides
A determinação de polifenóis totais foi realizada em espectrofotômetro UV 1800 (Shimadzu®, Kyoto, Japan) a um comprimento de onda de 760 nm. Foi construída uma curva padrão de ácido gálico (Sigma, Steinheim, Alemanha) nas concentrações de 5 a 75 mg/mL. Em balão volumétrico de 10 mL, foram adicionados às diferentes concentrações do padrão, 500 μL do reagente de Folin-Ciocalteu, 6 mL de água destilada, esperou-se 1 min, em seguida, adicionou-se 2 mL de solução de carbonato de sódio à 20 % (m/v) a solução foi agitada por 30 segundos, completou-se o volume com água destilada. As soluções permaneceram em repouso por 2 horas em seguida, realizou-se as leituras a 760 nm. Para a determinação do teor fenóis na polpa de jenipapo, o mesmo procedimento acima foi repetido com acréscimo de 100 μL da amostra. Os resultados foram expressos em miligramas de equivalentes de ácido gálico por grama de polpa (mg Eq AG. g-1polpa de jenipapo) (14).
A determinação de flavonoides totais foi realizada em espectrofotômetro UV 1800 (Shimadzu®, Kyoto, Japan) a um comprimento de onda de 425 nm. Foi construída uma curva padrão de Rutina nas concentrações de 5 a 30 mg/mL. Em balão volumétrico de 10 mL, adicionou-se às diferentes concentrações do padrão e acrescentou-se 1 mL de solução de cloreto de alumínio à 2.5 % (m/V). As soluções permaneceram em repouso por 30 minutos, em seguida, realizou-se as leituras a 425 nm. Para a determinação do teor de flavonoides na polpa de jenipapo, em balão volumétrico de 10 mL colocou-se 800 µL da amostra, 1 mL de solução de cloreto de alumínio à 2.5 % (m/V) e completouse o com metanol. Os resultados foram expressos em miligramas de rutina por grama de polpa mg Eq RUT. g-1polpa de jenipapo (14,15).
Atividade antioxidante
A atividade antioxidante pela captura do radical livre ABTS foi realizada em espectrofotômetro UV 1800 (Shimadzu®, Kyoto, Japan) a um comprimento de onda de 734 nm. Preparou-se o radical ABTS a partir da reação de 5 mL da solução estoque de ABTS (7 mM) com 88 µL da solução de persulfato de potássio (140 mM) e mantido em temper atura ambiente no escuro por 16 horas. Após o tempo necessário diluiu-se 1 mL da mistura em álcool etílico até obter a absorbância de 0.7 nm ± 0.05 nm a 734 nm no espectrômetro Shimadzu UV 1800. Em ambiente escuro transferiu-se uma alíquota de 30 µL da diluição do extrato para tubos de ensaio e misturou-se 3.0 mL da solução do radical ABTS. Em seguida, homogeneizou-se em vórtex e após 6 min da mistura realizou-se as leituras a 734 nm. Utilizou-se o álcool etílico como branco para calibrar o espectrofotômetro. A atividade antioxidante foi calculada baseando-se em uma curva padrão de trolox (100 µM-2.000 µM) e a concentração final expressa em µM Trolox (TE)/g (16).
A atividade antioxidante pela captura do radical livre DPPH foi realizada em espectrofotômetro UV 1800 (Shimadzu®, Kyoto, Japan) a um comprimento de onda de 515 nm. Em ambiente escuro transferiu-se uma alíquota de 150 µL da diluição da polpa para tubos de ensaio com 5.850 mL do radical DPPH e homogeneizou-se em vórtex. Após 30 min realizou-se a leitura em espectrofotômetro. A atividade antioxidante foi calculada baseando-se em uma curva padrão de Trolox (50µM-2000 µM) e a concentração final expressa em µM Trolox (TE)/g (17,18). As atividades antioxidantes medidas pela captura do ABTS e do DPPH foram calculadas em % de inibição, seguindo a equação 2.
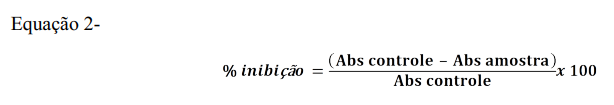
A atividade antioxidante pelo método de redução do ferro (FRAP) foi realizada espectrofotômetro UV 1800 (Shimadzu®, Kyoto, Japan) a um comprimento de onda de 595 nm. O reagente FRAP foi obtido a partir da combinação de 100 mL de tampão acetato 0,3 M, 10 mL de uma solução de TPTZ 10 mM e 10 mL de uma solução aquosa de cloreto férrico 20 mM, usado imediatamente após o preparo. Em ambiente escuro, transferiu-se uma alíquota de 90 μL da diluição do extrato para tubos de ensaio, acrescentou-se 270 μL de água destilada, 2,7 mL do reagente FRAP, homogeneizou-se em vórtex e manteve-se em banho-maria a 37 °C por 30 minutos. Em seguida realizouse a leitura a 595 nm. O reagente FRAP foi utilizado como branco para calibrar o espectrofotômetro. A atividade antioxidante foi calculada baseando-se em uma curva padrão de Trolox (160 µM-1.600 µM e a concentração final expressa em µM Trolox(TE)/g(19,20).
RESULTADOS E DISCUSSÕES
Caracterização físico- química da polpa do jenipapo maduro e verde
Aspectos físicos dos frutos de Jenipapo
A Tabela 1 mostra os resultados da caracterização física dos frutos verdes e maduros do Jenipapo. O peso médio encontrado do fruto maduro foi de 166,32g, sendo 50,10g das sementes, 35,91 g de casca e 75,26g de polpa (Tabela 1). Enquanto o fruto verde apresentou peso médio de 189,63g, sendo 58,75g de sementes, 44,14 de casca e 82,84 de polpa. Além dessas medidas, foi calculado o rendimento desses frutos cujo resultado foi 45,68% e 46,94%, para o fruto maduro e verde, respectivamente (Tabela 1).
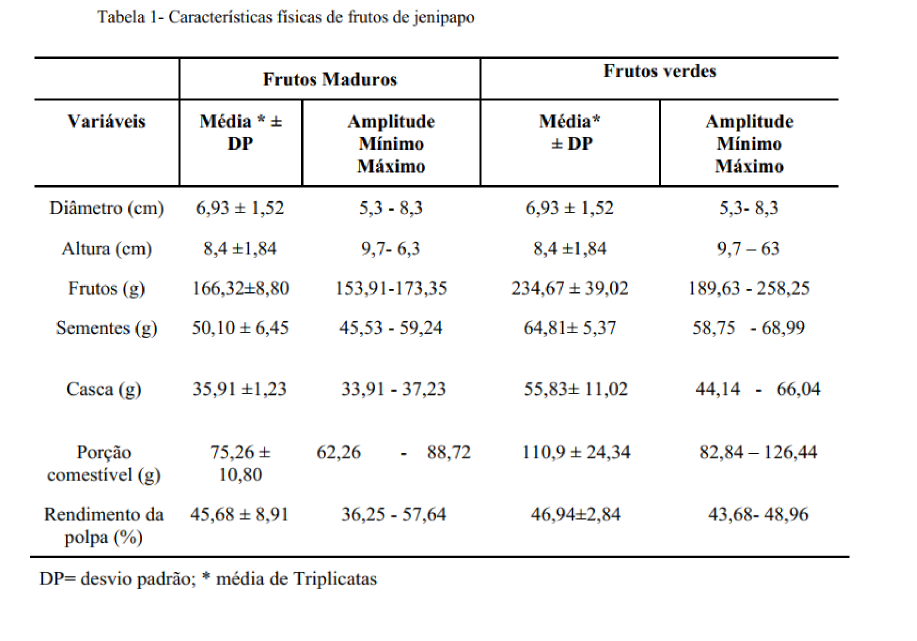
As características físicas dos frutos, como tamanho, são importantes para o mercado de frutas frescas, já que frutos de peso mais elevado são mais atrativos ao consumidor(21). Não existe legislação vigente determinando um padrão de tamanho para os frutos de jenipapo, porém, dados na literatura mostram que o jenipapo do cerrado brasileiro apresenta média de peso de 200g à 500g (22). A diferença de peso observada entre frutos de jenipapo do cerrado e o fruto estudado neste trabalho pode ser explicada por diversos fatores, em especial, pela influência que o clima e o solo da região exercem sobre características físicas das plantas. O estágio de maturação também influencia o tamanho dos frutos, por isso é observado a diferença de massa entre os frutos maduros e verdes em estudo neste trabalho (23).
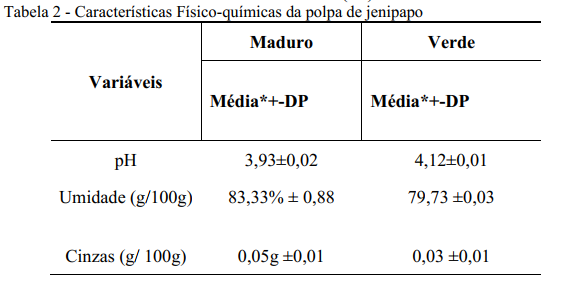
Os frutos de jenipapo foram submetidos a análises de determinação de cinzas, umidade e pH (Tabela 2). Os valores dessas características físico-química não apresentaram diferenças significativas (p<0.05) entre os frutos maduros e verdes (Tabela 2). As análises físico-químicas do jenipapo verde e maduro foram realizadas na polpa íntegra e no suco do jenipapo. O mesocarpo do jenipapo verde e do jenipapo maduro é fibroso e de difícil manipulação na realização das análises (24). Por isso, o caminho encontrado nesta pesquisa foi o processamento da polpa fibrosa em um liquidificador doméstico e posterior liofilização desse suco obtido. Excetuando-se as análises de cinzas e umidade, todas as demais foram realizadas no suco ou no produto liofilizado.
O fruto verde fornece um suco amarelo que escurece gradativamente até ficar azul escuro, esse suco é muito utilizado pelos nativos em suas pinturas ou para tingir os cabelos e o corpo (25). O mesmo acontece com o jenipapo maduro, mas o escurecimento ocorre numa velocidade menor. A determinação de pH foi realizada no suco do jenipapo verde e maduro, o valor de pH é decorrente da concentração de ácidos ionizados de uma solução aquosa. O teor de ácidos orgânicos pode influenciar esse valor, frutos verdes apresentam maiores quantidade de ácidos orgânicos, isso explica o menor valor de pH do jenipapo verde (26). Pode-se dizer que os ácidos orgânicos funcionam como reserva energética, essa afirmação é devido a conversão dos ácidos orgânicos em açúcares durante o processo de amadurecimento. Isso explica porque frutos maduros são doces e contém maior quantidade de açúcares, enquanto frutos verdes são azedos(27).
A pequena diferença entre os valores referentes à umidade encontrados nas análises do fruto verde (79,73%) e maduro (83,33%) (Tabela 2) são semelhantes com os já relatados em outros estudos sobre o jenipapo. Essas diferenças entre a umidade em diferentes estágios de maturação é bem comum na maioria das frutas(28).
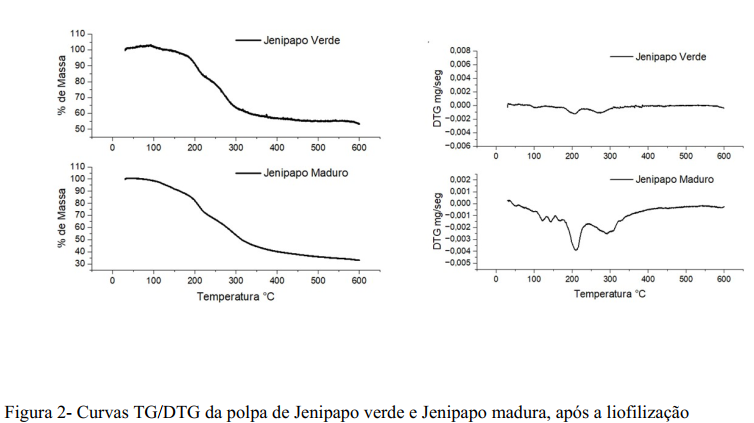
Em outra mão as curvas de termogravimetria (TG) são referentes às perdas de massa da polpa quando submetida à uma variação de temperatura. Os resultados de TG do fruto maduro mostra um início de perda de massa à temperatura de 100°C, provavelmente, está relacionada a evaporação de água e outros compostos voláteis presentes na polpa, o mesmo pode-se falar da curva TG do fruto verde (Figura 1). Após 100°C a curva mostra um declínio até a estabilização à temperatura de 400°C. Esse declínio é decorrente da degradação e evaporação dos componentes da polpa, como vitaminas, flavonoides, nutrientes, entre outros (15).
A termogravimetria é uma técnica analítica que tem como fundamento investigar as variações de massa de um material quando este é submetido a um aumento, controlado de temperatura. Geralmente é utilizada para verificar a estabilidade térmica de materiais. É comum a curva de termogravimetria (TG) não mostrar de modo claro os eventos de perda de massa, por isso calcula-se a derivada dessa curva, chamada de DTG, que através de picos mostra as alterações de massa da amostra durante o processo de aquecimento (Figura 2) (29). As duas amostras de jenipapo mostram dois eventos principais, mesmo que na DTG se observe mais de dois picos. A polpa de jenipapo é uma matriz complexa, ou seja, há uma grande mistura de substâncias que a compõem de diferentes massas molecular, resistência térmica e ponto de evaporação, isso faz com que as curvas TG/DTG mostrem vários eventos de perda de massa acontecendo quase que simultaneamente, sendo sem definição clara quando começa ou termina um evento. Isso é evidenciado na curva DTG, sempre que forma um pico, este não consegue retornar á linha de base, antes do início de outro pico (18,30).
Determinação de Flavonóides, Polifenóis e Atividade Antioxidante
De modo geral, frutas são ricas em compostos antioxidantes, como flavonoides, polifenóis, carotenoides, vitaminas entre outros (31). A polpa dos frutos verdes e maduros do jenipapo foram analisados quanto a quantificação de polifenóis, expressos em ácido gálico e quantificação de flavonoides, expressos em rutina (Tabela 3). Os frutos verdes apresentaram maior conteúdo de flavonoides (150,97 mg Eq Rut. g/ polpa) e polifenóis (300,69 mg Eq AG. g/polpa) do que o fruto maduro (flavonoides- 110,63 mg Eq Rut. g/ polpa e polifenóis- 180,30 mg Eq AG. g/polpa) (Tabela 3).
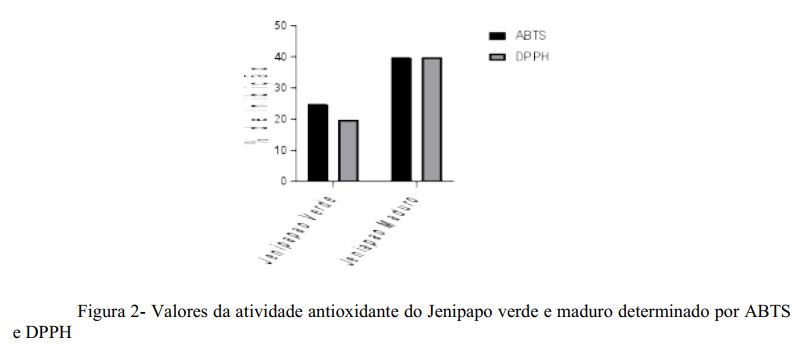
A atividade antioxidante dos frutos de jenipapo foi determinada pelos métodos DPPH, ABTS e FRAP. Em particular, os valores determinados pelos métodos DPPH e ABTS foram expressos em µM/Trolox e porcentagem de inibição (Figura 2), enquanto os determinados pelo método FRAP foram expressos apenas em µM/Trolox (Tabela 3). Quanto à atividade antioxidante, o fruto maduro mostrou maior capacidade antioxidante, pelos três métodos analisados, como mostra a Tabela 3.
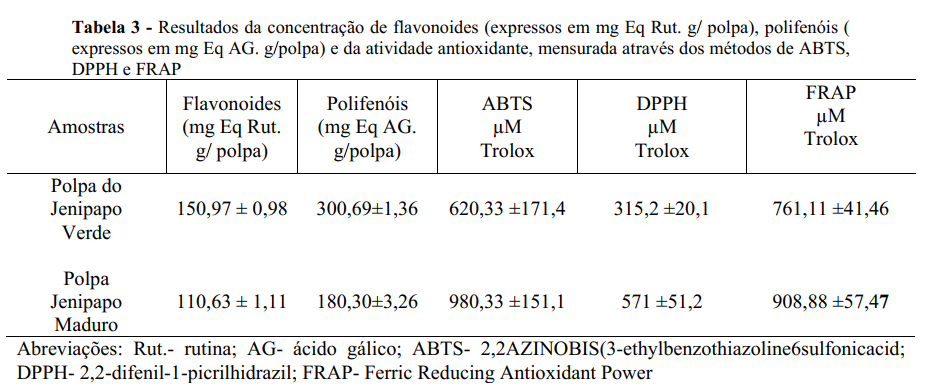
O teor de flavonoides e polifenóis foi maior na polpa do jenipapo verde. Bentes et al., (32), ao quantificar polifenóis na polpa do jenipapo maduro e verde (4,47ug/ml expressos em ácido clorafenolico), reportaram polifenóis apenas no fruto verde. Essa predominância de polifenóis na polpa do fruto verde, possivelmente, está relacionada a ação protetiva dos ácidos fenólicos contra herbívoros, por serem compostos de baixo peso molecular e baixa atividade enzimática, sua síntese é energeticamente favorável nos estágios iniciais de desenvolvimento do fruto (33).
Quanto à atividade antioxidante, o fruto maduro apresentou maiores valores nas três metodologias utilizadas FRAP, ABTS e DPPH. Enquanto o fruto verde mostrou porcentagem de inibição de cerca de 20% para o ABTS e o DPPH, o fruto maduro revelou o dobro disso (40%) (Figura 2). Isso pode ser explicado pela presença de vitamina C e principalmente carotenoides na polpa do fruto maduro, em maiores quantidades que no fruto verde (4,34). A atividade antioxidante identificada na polpa dos frutos verdes e maduros do jenipapo, biologicamente, se traduz na capacidade desses frutos diminuírem os efeitos deletérios dos radicais livres. Os radicais livres são moléculas formadas normalmente durante a respiração e a digestão de alimentos e podem causar danos às células e levar a diversas doenças graves, como aterosclerose e câncer. Quimicamente, são instáveis e procuram atingir a estabilidade através da obtenção de elétrons, que buscam em biomoléculas que fazem parte da composição das membranas celulares (Ex.: proteínas e lipídeos). Porém, quando uma proteína e lipídeo perde um elétron elas sofrem alterações na sua forma e função, tonando-se um novo radical livre, que através de dif erentes mecanismos fisiopatológicos contribuem para aparecimento e/ou evolução de doenças crônicas- degenerativas. Os antioxidantes funcionam na proteção do organismo contra a formação de radicais livres, por isso, a atividade antioxidante de frutas está relacionada à prevenção de diferentes doenças (9,18,20,35).
CONCLUSÕES
Os resultados obtidos por meio das análises do fruto do jenipapo apresentaram diferenças significativas entre o fruto verde e maduro. Quanto às suas características de pH, umidade e cinzas e a análise de estabilidade térmica realizada por termogravimetria, os valores desses parâmetros para os frutos maduros e verdes não foram muito distantes.
As maiores diferenças foram na atividade antioxidante e no conteúdo de polifenóis e de flavonoides. Enquanto os frutos verdes apresentam maior quantidade de polifenóis e de flavonoides, os frutos maduros apresentaram maior atividade antioxidante. Isso significa que ambos os frutos podem ser utilizados tecnologicamente para produção de alimentos funcionais, ou ainda como nutracêuticos para suplementação de antioxidantes.
REFERÊNCIAS
1. Especies-Arboreas-Brasileiras-vol-1-Jenipapeiro.pdf [Internet]. [citado 18 deagosto de 2024]. Disponível em:https://ainfo.cnptia.embrapa.br/digital/bitstream/item/231732/1/Especies-ArboreasBrasileiras-vol-1-Jenipapeiro.pdf
2. Góes da Conceição J, de Freitas Barbosa AG, de Matos Mendes da Silva I, deFreitas F, Macedo Almeida Camilo V. Preservation of the cultural identity of regionalproducts. Em: Preservation of the cultural identity of regional products [Internet]. 2021[citado 18 de agosto de 2024]. Disponível em:https://preprints.scielo.org/index.php/scielo/preprint/view/1660
3. Porto R, Cardoso B, Barros N, Cunha E, Araújo M, Moreira-Araújo R. ChemicalComposition and Antioxidant Activity of Genipa Americana L. (Jenipapo) of theBrazilian Cerrado. Journal of Agriculture and Environmental Sciences. 1o de janeiro de2014;3.
4. Dickson L, Tenon M, Svilar L, Fança-Berthon P, Martin JC, Rogez H, et al.Genipap (Genipa americana L.) juice intake biomarkers after medium-termconsumption. Food Research International [Internet]. 1o de novembro de 2020 [citado18 de agosto de 2024];137:109375. Disponível em:https://www.sciencedirect.com/science/article/pii/S0963996920304002
5. Erbano M, Duarte MR. Morfoanatomia de folha e caule de Genipa americana L.,Rubiaceae. Rev bras farmacogn [Internet]. dezembro de 2010 [citado 18 de agosto de2024];20:825–32. Disponível em:https://www.scielo.br/j/rbfar/a/pjLhRsJdmsgVZ5SMZ6HJymv/
6. Santos AC, Otsuka FAM, Santos RB, Trindade DJ, Matos HR. Antiglycationpotential and antioxidant activity of genipap (Genipa americana L.) in oxidative stressmediated by hydrogen peroxide on cell culture. Natural Product Research [Internet]. 1ode junho de 2023 [citado 18 de agosto de 2024];37(12):2065–9. Disponível em:https://www.sciencedirect.com/org/science/article/pii/S1478641923002802
7. Assis RC de, Monteiro GR, Valentim AB, Maia CSC, Felipe SM da S, FreitasRabelo CA, et al. Biological properties of bioactive compounds from the fruit andleaves of the genipap tree (Genipa americana L.): A systematic review. FoodBioscience [Internet]. 1o de junho de 2023 [citado 18 de agosto de 2024];53:102514.Disponível em: https://www.sciencedirect.com/science/article/pii/S2212429223001657
8. Olatunde A, Ogunro OB, Tijjani H, Shariati MA, Mubarak MS, RengasamyKRR. Chemical constituents and antioxidant potential of African Fruits. South AfricanJournal of Botany [Internet]. 1o de março de 2024 [citado 18 de agosto de2024];166:126–50. Disponível em:https://www.sciencedirect.com/science/article/pii/S0254629924000164
9. Arulselvan P, Fard MT, Tan WS, Gothai S, Fakurazi S, Norhaizan ME, et al.Role of Antioxidants and Natural Products in Inflammation. Oxidative Medicine andCellular Longevity [Internet]. 10 de outubro de 2016 [citado 5 de novembro de 2023];2016:e5276130. Disponível em: https://www.hindawi.com/journals/omcl/2016/5276130/
10. Brewer M s. Natural Antioxidants: Sources, Compounds, Mechanisms ofAction, and Potential Applications. Comprehensive Reviews in Food Science and FoodSafety [Internet]. 2011 [citado 18 de janeiro de 2023];10(4):221–47. Disponível em:https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1541-4337.2011.00156.x
11. Mehmood T, Ahmad A, Ahmed A, Ahmed Z. Optimization of olive oil basedO/W nanoemulsions prepared through ultrasonic homogenization: A response surfacemethodology approach. Food Chem. 15 de agosto de 2017;229:790–6.
12. Shebis Y, Iluz D, Kinel-Tahan Y, Dubinsky Z, Yehoshua Y. NaturalAntioxidants: Function and Sources. Food and Nutrition Sciences [Internet]. 5 de junhode 2013 [citado 18 de agosto de 2024];4(6):643–9. Disponível em:https://www.scirp.org/journal/paperinformation?paperid=32918
13. NormasADOLFOLUTZ.pdf [Internet]. [citado 17 de agosto de 2024].Disponível em:https://wp.ufpel.edu.br/nutricaobromatologia/files/2013/07/NormasADOLFOLUTZ.pdf
14. Ferreira LM de MC, Pereira RR, Carvalho-Guimarães FB de, Remígio MS do N,Barbosa WLR, Ribeiro-Costa RM, et al. Microencapsulation by Spray Drying andAntioxidant Activity of Phenolic Compounds from Tucuma Coproduct (Astrocaryumvulgare Mart.) Almonds. Polymers [Internet]. janeiro de 2022 [citado 5 de janeiro de2023];14(14):2905. Disponível em: https://www.mdpi.com/2073-4360/14/14/2905
15. Ferreira LM de MC, Pereira RR, Carvalho FB de, Silva Santos A, Ribeiro-CostaRM, Carréra Silva Júnior JO. Green Extraction by Ultrasound, Microencapsulation bySpray Drying and Antioxidant Activity of the Tucuma Coproduct (Astrocaryum vulgareMart.) Almonds. Biomolecules [Internet]. abril de 2021 [citado 9 de dezembro de2022];11(4):545. Disponível em: https://www.mdpi.com/2218-273X/11/4/545
16. Rufino M, Alves R, Brito E, Morais S, Sampaio C, Pérez-Jiménez J.Metodologia Científica: Determinaão da atividade antioxidante total em frutas pelacaptura do radical ABTS+. Embrapa Agroindústria Tropical Comunicado Técnico. 1ode janeiro de 2007;127.
17. Rufino M do SM, Alves RE, Brito ES de, Morais SM de, Sampaio C de G, Pérez- Jiménez J, et al. Metodologia científica: determinação da atividade antioxidante totalem frutas pela captura do radical livre DPPH. 2007 [citado 18 de agosto de 2024];Disponível em: http://www.infoteca.cnptia.embrapa.br/handle/doc/426953
18. Ferreira LM de MC, Souza PDQ de, Pereira RR, Silva EO da, Barbosa WLR,Silva-Júnior JOC, et al. Preliminary Study on the Chemical and Biological Properties ofPropolis Extract from Stingless Bees from the Northern Region of Brazil. Processes[Internet]. abril de 2024 [citado 29 de março de 2024];12(4):700. Disponível em:https://www.mdpi.com/2227-9717/12/4/700
19. Rufino M do SM, Alves RE, Brito ES de, Morais SM de, Sampaio C de G,Pérez-Jiménez J, et al. Metodologia científica: determinação da atividade antioxidantetotal em frutas pelo método de redução do ferro (FRAP). 2006 [citado 18 de agosto de2024]; Disponível em: http://www.infoteca.cnptia.embrapa.br/handle/doc/664098
20. Ferreira LM de MC, Modesto YY, Souza PDQ de, Nascimento FC de A, PereiraRR, Converti A, et al. Characterization, Biocompatibility and Antioxidant Activity ofHydrogels Containing Propolis Extract as an Alternative Treatment in Wound Healing.Pharmaceuticals [Internet]. maio de 2024 [citado 18 de agosto de 2024];17(5):575.Disponível em: https://www.mdpi.com/1424-8247/17/5/575
21. Silva AP da, Lima CLC de, Vieites RL. CARACTERIZAÇÃO QUÍMICA EFÍSICA DO JENIPAPO (Genipa americana L.) ARMAZENADO. Sci agric (Piracicaba,Braz) [Internet]. janeiro de 1998 [citado 1o de dezembro de 2023];55:29–34. Disponívelem: https://www.scielo.br/j/sa/a/ws9hXwz9qYNJ3sKcs5wYJKb/?format=html
22. EMBRAPA.http://www.agabrasil.org.br/_Dinamicos/livro_frutas_nativas_Embrapa.pdf [Internet].[citado 18 de agosto de 2024]. Disponível em:http://www.agabrasil.org.br/_Dinamicos/livro_frutas_nativas_Embrapa.pdf
23. Sharma D, dhvi M, Chauhan A. Effect of environmental factors on vegetablesproduction. 1o de janeiro de 2020;610–2.
24. Dickson L, Tenon M, Svilar L, Fança-Berthon P, Martin JC, Rogez H, et al.Genipap (Genipa americana L.) juice intake biomarkers after medium-termconsumption. Food Res Int. novembro de 2020;137:109375.
25. Náthia-Neves G, Vardanega R, Meireles MAA. Extraction of natural bluecolorant from Genipa americana L. using green technologies: Techno-economicevaluation. Food and Bioproducts Processing [Internet]. 1o de março de 2019 [citado 18de agosto de 2024];114:132–43. Disponível em:https://www.sciencedirect.com/science/article/pii/S0960308518306126
26. Batista-Silva W, Nascimento VL, Medeiros DB, Nunes-Nesi A, Ribeiro DM,Zsögön A, et al. Modifications in Organic Acid Profiles During Fruit Development andRipening: Correlation or Causation? Front Plant Sci [Internet]. 20 de novembro de 2018[citado 18 de agosto de 2024];9:1689. Disponível em:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6256983/
27. Zheng B, Zhao L, Jiang X, Cherono S, Liu J, Ogutu C, et al. Assessment oforganic acid accumulation and its related genes in peach. Food Chemistry [Internet]. 1ode janeiro de 2021 [citado 18 de agosto de 2024];334:127567. Disponível em:https://www.sciencedirect.com/science/article/pii/S0308814620314291
28. Shin Y, Ryu JA, Liu RH, Nock JF, Watkins CB. Harvest maturity, storagetemperature and relative humidity affect fruit quality, antioxidant contents and activity,and inhibition of cell proliferation of strawberry fruit. Postharvest Biology andTechnology [Internet]. 1o de agosto de 2008 [citado 18 de agosto de 2024];49(2):201–9.Disponível em: https://www.sciencedirect.com/science/article/pii/S0925521408000781
29. Neves FB, Zanin LL, Pereira RR, Júnior JOCS, Costa RMR, Porto ALM,Yoshioka SA, Oliveira ANd, Jimenez DEQ, Ferreira IM. Chitin and Silk FibroinBiopolymers Modified by Oxone: Efficient Heterogeneous Catalysts for KnoevenagelReaction. Catalysts. [citado 18 de agosto de 2024]. Disponível em:https://www.mdpi.com/2073-4344/12/8/904
30. Correa KL, de Carvalho-Guimarães FB, Mourão ES, Oliveira Santos HC, daCosta Sanches SC, Lamarão MLN, et al. Physicochemical and Nutritional Properties ofVegetable Oils from Brazil Diversity and Their Applications in the Food Industry.Foods [Internet]. janeiro de 2024 [citado 17 de agosto de 2024];13(10):1565. Disponível em: https://www.mdpi.com/2304-8158/13/10/1565
31. Rahaman MdM, Hossain R, Herrera‐Bravo J, Islam MT, Atolani O, AdeyemiOS, et al. Natural antioxidants from some fruits, seeds, foods, natural products, andassociated health benefits: An update. Food Sci Nutr [Internet]. 13 de janeiro de 2023[citado 18 de agosto de 2024];11(4):1657–70. Disponível em:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10084981/
32. Bentes A de S, Mercadante AZ. Influence of the Stage of Ripeness on theComposition of Iridoids and Phenolic Compounds in Genipap (Genipa americana L.). J Agric Food Chem [Internet]. 5 de novembro de 2014 [citado 18 de agosto de 2024];62(44):10800–8. Disponível em: https://doi.org/10.1021/jf503378k
33. Baby S, Raj G, Thaha ARM, Dan M. Volatile chemistry of a plant: monosesquiterpenoid pattern in the growth cycle of Curcuma haritha. Flavour and FragranceJournal [Internet]. 2010 [citado 18 de agosto de 2024];25(1):35–40. Disponível em:https://onlinelibrary.wiley.com/doi/abs/10.1002/ffj.1955
34. Ribeiro J, Barros H, Macedo Viana E, Gualberto S, Silva A, Souza C, et al.Composition, Antinutrients and Antioxidant Capacity of Genipap (Genipa americanaL.): Activity of Phenolic Constituents on the Thermal Stability of β-carotene. Journal ofCulinary Science & Technology [Internet]. 4 de março de 2023 [citado 18 de agosto de2024];21(2):215–37. Disponível em: https://doi.org/10.1080/15428052.2021.1914263
35. Bonamigo T, Campos JF, Alfredo TM, Balestieri JBP, Cardoso CAL, ParedesGamero EJ, et al. Antioxidant, Cytotoxic, and Toxic Activities of Propolis from TwoNative Bees in Brazil: Scaptotrigona depilis and Melipona quadrifasciata anthidioides.Oxidative Medicine and Cellular Longevity [Internet]. 9 de março de 2017 [citado 5 denovembro de 2023];2017:e1038153. Disponível em:https://www.hindawi.com/journals/omcl/2017/1038153/.


